1. Pendalaman Sifat Koligatif
Sifat koligatif disebut “koligatif” yang berasal dari bahasa Latin colligare yang memiliki arti “terikat bersama” karena sifat-sifat ini berhubungan erat dengan jumlah partikel yang ada dalam larutan, bukan berdasarkan pada identitas atau jenis kimianya. Dengan kata lain, sifat koligatif bergantung pada banyaknya partikel yang terlarut, tanpa memperhatikan jenis zat yang terlibat dalam larutan tersebut.
A. Penurunan Tekanan Uap (Hukum Raoult)
Ketika zat terlarut non-volatil (tidak mudah menguap) ditambahkan ke pelarut, molekul zat terlarut tersebut menempati sebagian ruang di permukaan cairan. Hal ini menghalangi molekul pelarut untuk lepas ke fase gas.
- Rumus: $P_{\text{larutan}} = X_{\text{pelarut}} \cdot P^\circ_{\text{pelarut}}$
- Konsekuensi: Karena tekanan uap turun, larutan membutuhkan suhu lebih tinggi untuk mencapai tekanan atmosfer (didih), yang menjelaskan fenomena kenaikan titik didih.
B. Kenaikan Titik Didih & Penurunan Titik Beku
Fenomena ini dapat dijelaskan dengan diagram fasa. Penambahan zat terlarut memperluas rentang fase cair.
- Titik Beku: Kehadiran zat terlarut dalam larutan mengganggu proses pembentukan kisi kristal padat yang teratur dan rapi. Akibat gangguan ini, suhu larutan harus diturunkan lebih jauh dari titik beku murni agar proses pembekuan dapat terjadi. Dengan kata lain, zat terlarut menyebabkan penurunan suhu beku karena menghambat pembentukan struktur kristal yang stabil.
- Rumus: $\Delta T_f = K_f \cdot m \cdot i$ dan $\Delta T_b = K_b \cdot m \cdot i$
- $i$ adalah Faktor Van’t Hoff, yang memperhitungkan jumlah partikel jika zat tersebut terionisasi (misalnya NaCl, $i=2$).
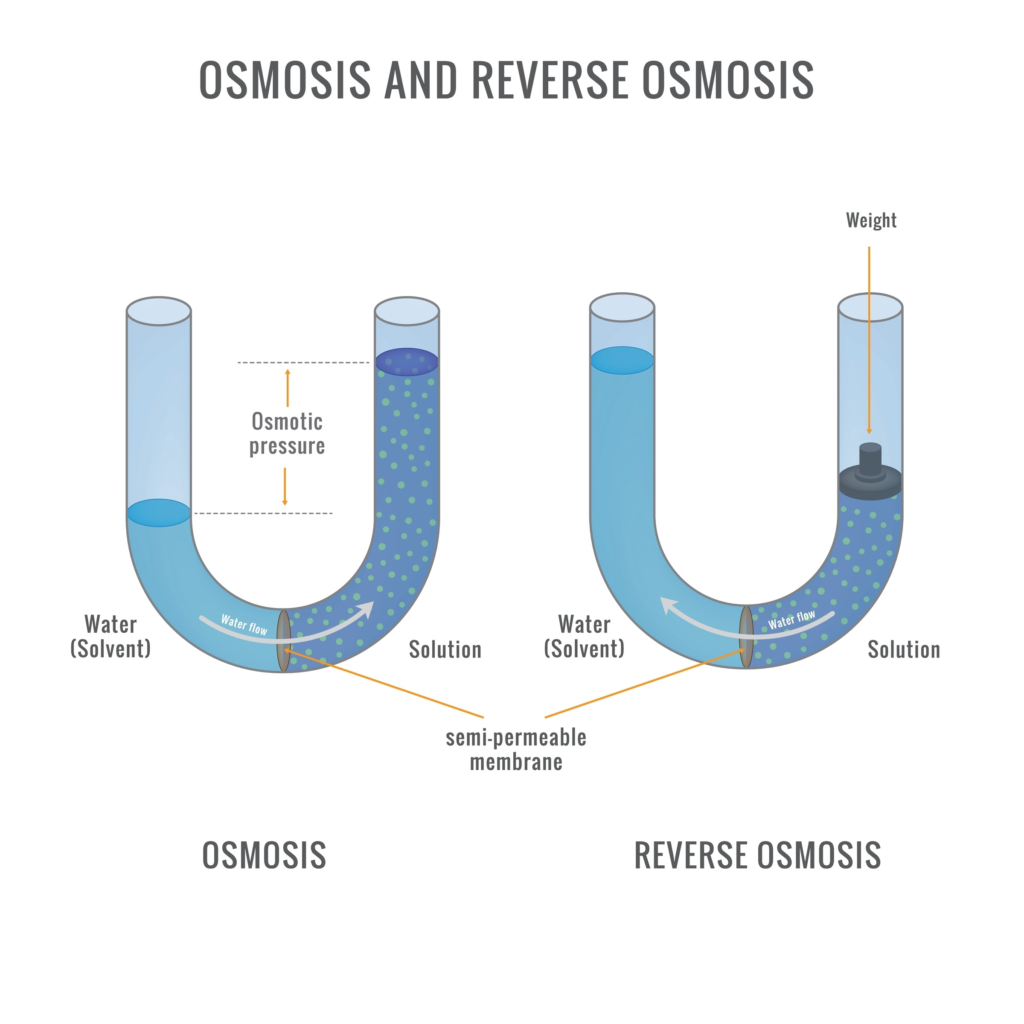
C. Tekanan Osmotik ($\pi$)
Ini adalah salah satu sifat koligatif yang paling sensitif dan penting, terutama ketika berhadapan dengan molekul-molekul besar. Osmosis merupakan proses di mana pelarut murni mengalir secara alami ke dalam larutan melalui membran yang bersifat semipermeabel, yang memungkinkan hanya pelarut tertentu untuk melewati membran tersebut.
- Rumus: $\pi = M R T$
- Pentingnya: Dalam dunia medis, cairan infus harus isotonik (memiliki tekanan osmotik yang sama) dengan sel darah merah agar sel tidak pecah (hemolisis) atau mengkerut (krenasi).
2. Kimia Makromolekul (Polimer)
Makromolekul memiliki berat molekul yang sangat besar (biasanya $> 10.000$ g/mol). Karena ukurannya, sifat fisiknya sangat berbeda dari molekul kecil.
A. Konsep Massa Molar Rata-Rata
Dalam sampel polimer sintetis, tidak semua rantai memiliki panjang yang sama (polidispersi). Oleh karena itu, kita mengenal dua jenis rata-rata:
- Massa Molar Rata-Rata Jumlah ($\bar{M}_n$): Dihitung berdasarkan jumlah partikel (sangat dipengaruhi oleh molekul kecil). Ditentukan dengan Osmometri.
- Massa Molar Rata-Rata Berat ($\bar{M}_w$): Dihitung berdasarkan massa total (sangat dipengaruhi oleh molekul besar). Ditentukan dengan Hamburan Cahaya.
B. Konfigurasi dan Konformasi
- Konfigurasi: Susunan atom yang tetap (misalnya cis atau trans pada karet).
- Konformasi: Bentuk molekul yang berubah-ubah karena rotasi di sekitar ikatan tunggal. Molekul polimer seringkali berbentuk seperti “gulungan acak” (random coil) di dalam larutan.
3. Menentukan Massa Molar menggunakan Sifat Koligatif
Mengapa tekanan osmotik lebih disukai daripada penurunan titik beku untuk mengukur massa molar protein atau plastik?
- Besarnya Efek: Untuk makromolekul, konsentrasi massa yang tinggi sekalipun hanya menghasilkan jumlah mol yang sangat kecil.
- Penurunan titik beku mungkin hanya sekitar $0.0001$°C (sulit diukur).
- Tekanan osmotik bisa menghasilkan tinggi kolom cairan beberapa sentimeter (mudah diukur dengan akurat).
- Stabilitas Suhu: Mengukur tekanan osmotik dapat dilakukan pada suhu kamar ($25$°C), sedangkan titik didih atau titik beku dapat merusak struktur protein (denaturasi).
4. Viskositas Larutan Polimer
Salah satu cara paling sederhana untuk mempelajari makromolekul adalah melalui Viskositas. Molekul polimer yang panjang akan berinteraksi dan saling “menyangkut” dalam pelarut, meningkatkan hambatan aliran secara drastis. Hubungan ini dinyatakan dalam Persamaan Mark-Houwink:
$$[\eta] = K \cdot M^a$$
Di mana $[\eta]$ adalah viskositas intrinsik dan $M$ adalah massa molar.
